Chez des papillons, la diversité des motifs colorés tient à leur fardeau génétique
Différents individus d’une population expriment parfois des types comportementaux ou morphologiques bien distincts, dus à la variation simultanée de plusieurs caractères. Génétiquement, ces types bien contrastés reflètent souvent des changements dans la structure des chromosomes, parfois très anciens. Mais pourquoi ces types persistent-ils ainsi sans que l’un finisse par s’imposer ? Une équipe de chercheurs issus du Centre d'Ecologie Fonctionnelle et Evolutive (CEFE - Univ Montpellier/CNRS/EPHE/IRD/Univ Paul Valéry Montpellier 3), du Laboratoire écologie, évolution, interactions des systèmes amazoniens (LEEISA - Univ De Guyane/CNRS/IFREMER), de l’Institut de Systématique, Evolution, Biodiversité (ISYEB – MNHN/ CNRS/UPMC/EPHE/Sorbonne Université), du Biocampus Montpellier (Univ Montpellier/CNRS/INSERM) et de l’Université d’Auckland (Nouvelle-Zélande) a percé ce mystère en étudiant les couleurs des papillons tropicaux. Leurs travaux, parus dans la revue Nature Genetics, ont révélé que les changements chromosomiques qui déterminent des colorations mimétiques très avantageuses sont associés à un véritable fardeau de mutations délétères, ce qui les empêche d’évincer complètement les colorations moins avantageuses, au fil des générations. Cette étude montre que la diversité des adaptations, et leur maintien à long terme, s’explique en partie par leurs effets indésirables associés.
Chez de nombreuses espèces animales ou végétales, on observe souvent que plusieurs caractères varient simultanément entre individus d’une même population. Ces polymorphismes complexes peuvent prendre la forme, par exemple, de tactiques reproductrices distinctes au sein d’une population d’oiseaux, comme chez les combattants variés dont les mâles diffèrent à la fois par la couleur de leur plumage, leur comportement nuptial, et la taille de leurs testicules. D’autres exemples célèbres comprennent les motifs colorés des ailes des papillons, mais aussi les différentes tactiques florales chez les primevères ou le sarrasin, les types sociaux des fourmis de feu, ou encore les syndromes de migration des saumons. On sait que ces polymorphismes sont contrôlés génétiquement par des « supergènes », architecture génétique particulière impliquant des changements dans la structure des chromosomes. Ces changements, en particulier ceux qui concernent l’inversion de l’orientation de l’ADN dans certaines régions des chromosomes, empêchent la recombinaison génique, et donc le brassage génétique, d’avoir lieu lors de la formation des gamètes. Cette propriété fait que différentes combinaisons de caractères, s’ils sont contrôlés par des gènes inclus dans ces inversions, peuvent être transmises en bloc entre générations, sans se métisser. Cela explique bien la variation simultanée de différents caractères dans les exemples cités, mais pas pourquoi la sélection naturelle ne favorise pas un seul morphe, le plus adapté, et ne mène pas les autres à disparaître de la population.

Crédit photo : Mathieu Joron
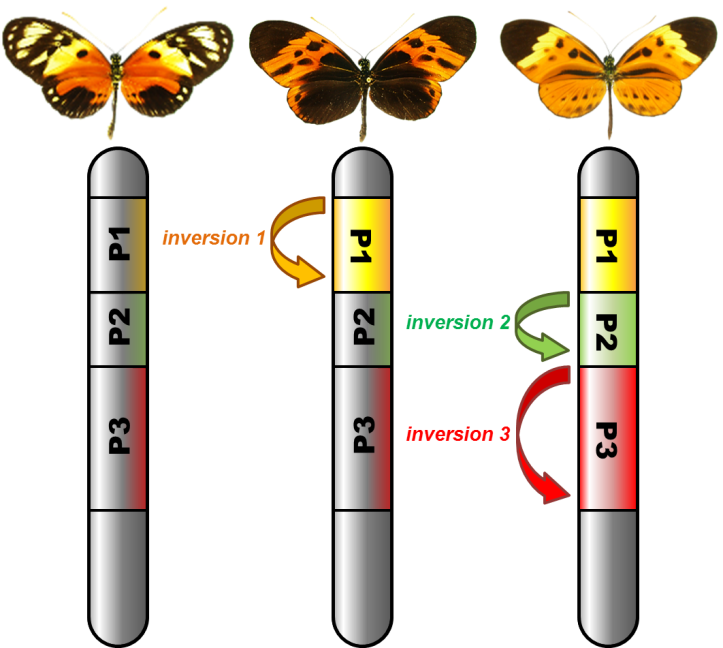
Une équipe de chercheurs du Centre d'Ecologie Fonctionnelle et Evolutive (CEFE - Univ Montpellier/CNRS/EPHE/IRD/Univ Paul Valéry Montpellier 3), du Laboratoire écologie, évolution, interactions des systèmes amazoniens (LEEISA - Univ De Guyane/CNRS/IFREMER), de l’Institut de Systématique, Evolution, Biodiversité (ISYEB – MNHN/ CNRS/UPMC/EPHE/Sorbonne Université), du Biocampus Montpellier (Univ Montpellier/CNRS/INSERM) et de l’Université d’Auckland (Nouvelle-Zélande) a cherché à élucider quelles propriétés des inversions chromosomiques les conduit à perdurer sous différentes versions, et comment une diversité de morphes se maintient au sein d’une même population. Pour cela, ils ont établi leur terrain d’étude en Amazonie, au Pérou, pour étudier le papillon Heliconius numata. Ce papillon hautement toxique, qui exhibe de vifs motifs de coloration reconnus comme signaux d’avertissement par ses prédateurs, a la particularité de présenter jusqu’à 7 motifs colorés distincts, au sein d’une même population. Ces morphes sont associés à différentes inversions chromosomiques. À travers une dissection fine des avantages écologiques que procurent ces inversions, de leur contenu génomique, et de leur histoire évolutive, les scientifiques ont recherché les facteurs qui expliquent la coexistence d’individus arborant ces colorations très différentes.
Dans leurs travaux publiés dans la revue Nature Genetics, ils montrent que les propriétés des inversions chromosomiques les conduisent à s’associer lors de leur formation, puis au cours de leur histoire évolutive, à de nombreuses mutations dites délétères. Les mutations délétères sont nombreuses dans un génome mais elles restent en faible fréquence, éliminées par la sélection naturelle grâce au brassage génétique. Mais les choses sont différentes si ces mutations affectent un gène situé dans une inversion, car elles sont alors indissociables des autres gènes de l’inversion. Si une inversion chromosomique est associée à certains traits écologiques avantageux, par exemple un motif d’avertissement efficace contre les prédateurs comme chez ces papillons tropicaux, les mutations délétères s’y maintiennent plus facilement qu’ailleurs dans le génome, surtout si elles sont récessives et ne s’expriment que rarement. Des mutations peuvent ainsi s’accumuler, selon un processus bien décrit par la théorie, et finir par former un surplus de mutations aux effets négatifs, véritable fardeau porté par l’inversion. C’est ce processus que vient démontrer empiriquement l’étude de ces papillons. Bien qu’elles apportent un bénéfice écologique très fort aux papillons à travers la coloration d’avertissement, les inversions sont envahies, "polluées", par des mutations et éléments génétiques délétères qui induisent une forte mortalité chez les chenilles lorsqu’elles sont homozygotes. A la fois ces effets positifs et négatifs sont liés au blocage de la recombinaison suscité par l’inversion, et constituent deux faces d’une même médaille. C’est l’effet combiné de ces deux forces qui explique pourquoi ces inversions sont présentes chez seulement une partie des individus, et donc pourquoi une diversité de colorations perdure chez cette espèce depuis au moins 2 millions d’années.
Au-delà de l’étude de la coloration chez ce papillon, cette étude est un des premiers exemples montrant que des mutations délétères s'accumulent avec le temps dans les inversions, en raison de leur effet sur la recombinaison génétique. Ce processus pourrait expliquer de nombreux cas de variation dans la structure des génomes associés à une multitude d'exemples notoires de diversité de stratégies sexuelles ou de pollinisation, de colorations, de comportements, de systèmes immunitaires, ou de physiologie chez des organismes très divers, y compris les humains. À une plus large échelle, ces résultats permettent de mieux comprendre les forces qui déterminent l’évolution des génomes dans la nature.
Crédit photo : Mathieu Joron
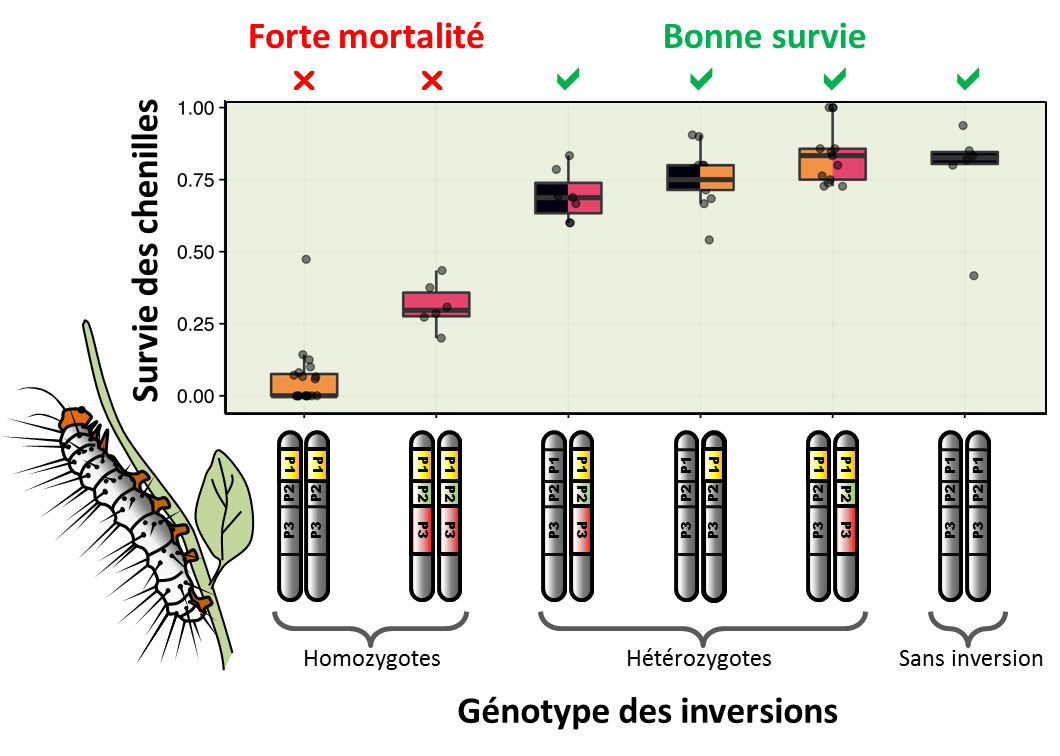
Fig.4. Augmentation de la mortalité juvénile lorsque les inversions sont homozygotes. Associées à des motifs colorés protecteurs, les inversions confèrent un avantage et se répandent dans la population, mais elles ne peuvent envahir la population et éliminer complètement le type chromosomique sans inversion moins bien protégé. En effet, étant chargées de mutations délétères, leur avantage diminue à mesure qu'elles deviennent plus fréquentes et forment des homozygotes qui meurent sous forme de chenille. Autrement dit, les inversions ne sont avantageuses que lorsqu’elles sont hétérozygotes.
Crédit photo: M Joron et M Chouteau.
Les objectifs de développement durable

ODD 15 : Vie terrestre
Cette étude sur des insectes amazoniens contribue à mieux comprendre le vivant, les populations naturelles, l’adaptation biologique, et le fonctionnement durable des écosystèmes.
Références
Jay P, Chouteau M, Whibley A, Bastide H, Parrinello H, Llaurens V, & Joron M. Mutation load at a mimicry supergene sheds new light on the evolution of inversion polymorphisms. Nature Genetics. 2020: in press.
