Comprendre les facteurs d'expansion des résistances antibiotiques pour mieux les freiner
Les résistances aux antibiotiques menacent le succès du traitement des infections bactériennes. Dans une étude publiée dans eLife, des scientifiques ont traqué à l’échelle mondiale, par des approches bioinformatiques, tous les gènes de résistance aux aminoglycosides (une famille d’antibiotiques). Ils ont établi que leur répartition était déterminée plutôt par des différences entre écosystèmes et par les échanges commerciaux et les migrations que par la consommation d’aminoglycosides. Cette étude fournit des pistes pour établir des mesures de contrôle et propose des outils pour surveiller la propagation des résistances.
L’émergence et la propagation des résistances et multirésistances antibiotiques constituent aujourd’hui une vraie crise de santé publique. Il est donc primordial de comprendre les facteurs qui favorisent et orientent la propagation des gènes de résistance. Pendant les dernières décennies, de nombreuses données ont été collectées à ce sujet au travers d’études descriptives détaillées mais souvent à petite échelle spatiale et écologique. Des scientifiques ont mené une étude sur les résistances aux aminoglycosides à l’échelle mondiale. Les aminoglycosides sont une famille d’antibiotiques découverte et introduite en clinique dans les années 40. Même si leur prescription en médecine humaine a fortement décliné dans les 30 dernières années, les aminoglycosides restent un traitement de dernier recours pour des infections bactériennes résistantes et continuent à être utilisées assez largement en médecine vétérinaire.
En utilisant des méthodes d’analyse génomique et de bioinformatique, les chercheuses et chercheurs ont généré une base de données répertoriant dans tous les génomes de bactéries disponibles la présence de gènes qui peuvent conférer une résistance aux aminoglycosides. Cette base de données contient pour chaque gène la famille à laquelle il appartient, l’isolat bactérien dans lequel il était présent, mais aussi les métadonnées associées à cet isolat (lieu, date et biome de collecte). Ils ont de plus déterminé la localisation de chaque gène de résistance à l’intérieur du génome et en particulier s’il était associé à ou porté par un élément génétique mobile (plasmide, transposon…) qui favorise les échanges horizontaux de matériel génétique entre bactéries d’espèces différentes.
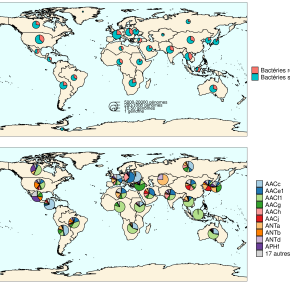
La base de données ainsi créée fournit une description spatio-temporelle au niveau mondial de la répartition des gènes de résistance aux aminoglycosides. Elle a permis par exemple de mettre en évidence que les résistances aux aminoglycosides sont ubiquitaires : elles sont présentes sur tous les continents et dans tous les types d’écosystèmes considérés. De plus, cette base de données démontre une coexistence pendant des décennies de plusieurs familles de gènes de résistance, plutôt qu’une succession, tant au niveau local qu’au niveau global. Cependant, si au fur et à mesure du temps, le nombre de façons de résister aux aminoglycosides augmente, la prévalence des bactéries résistantes aux antibiotiques stagne depuis les années 1990, tant au niveau européen qu’au niveau mondial. Les auteurs de cette étude ont également établi que les différentes familles de gènes de résistance ont des extensions phylogénétiques très contrastées, c’est-à-dire que certaines familles de gènes sont fortement associées à un nombre limité d’espèces très proches entre elles, alors que d’autres familles de gènes sont présentes dans un nombre important d’espèces très éloignées les unes des autres. Finalement, ces travaux ont permis de déterminer que différentes familles de gènes présentent des niveaux d’association aux éléments génétiques mobiles très variables, allant de 0 à 100 %.
Ensuite, par des approches statistiques, les scientifiques ont montré que sur la période 1997-2018, en Europe, la consommation humaine et vétérinaire d’aminoglycosides est un facteur qui contribue très peu à expliquer les variations de fréquence des résistances. En revanche, ils ont déterminé que les flux de marchandises et de personnes et encore plus l’appartenance à un biome ou grand type d’écosystème sont des déterminants-clés de ces fréquences. De surcroît, l’équipe a inféré un réseau des transferts probables de résistances entre écosystèmes. Ce réseau suggère que les sols et la faune et la flore sauvage sont les écosystèmes-clés à surveiller pour prédire la circulation des résistances aux aminoglycosides.
Ces analyses ont donc permis d’établir à un niveau global que la sélection par les antibiotiques dans l’environnement est loin d’être la seule force évolutive qui conduit à la propagation et au maintien des résistances aux aminoglycosides. Cela suggère que les mesures de réduction d’usage des antibiotiques, même si elles sont clairement nécessaires, ne seront pas suffisantes pour aboutir à une diminution des fréquences des résistances aux aminoglycosides. Elles doivent absolument être couplées d’une part à des mesures de surveillance des bactéries et résistances associées aux importations, et d’autre part à des approches de description et de surveillance de l’ensemble des résistances présentes (le résistome), en particulier dans les écosystèmes-clés pour la circulation de ces résistances.
Enfin, les conclusions de cette étude sont spécifiques des aminoglycosides et de leurs résistances associées, mais la méthodologie développée pourra être appliquée à d’autres familles de gènes de résistance et à d’autres échelles spatiales pour obtenir un panorama des fréquences de résistances et un diagnostic des facteurs qui expliquent leur circulation ou leur expansion.
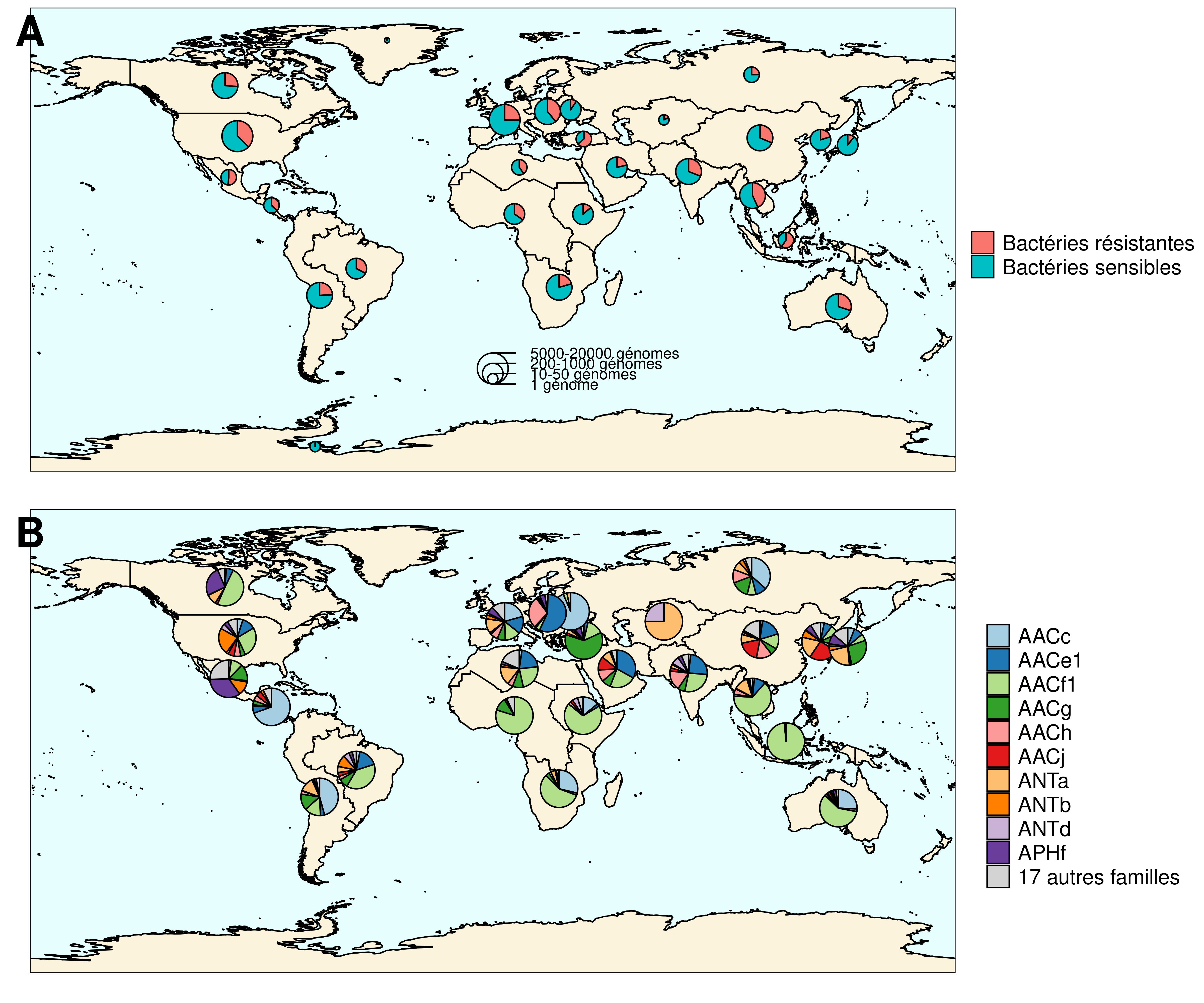
B. Diversité des gène de résistance aux aminoglycosides à l’échelle mondiale. Pour chaque grande zone géographique, la proportion de chaque famille de gènes de résistance parmi tous les gènes de résistance détecté est représentée. La taille des cercles n’est pas liée au nombre de génomes analysés pour chaque zone.
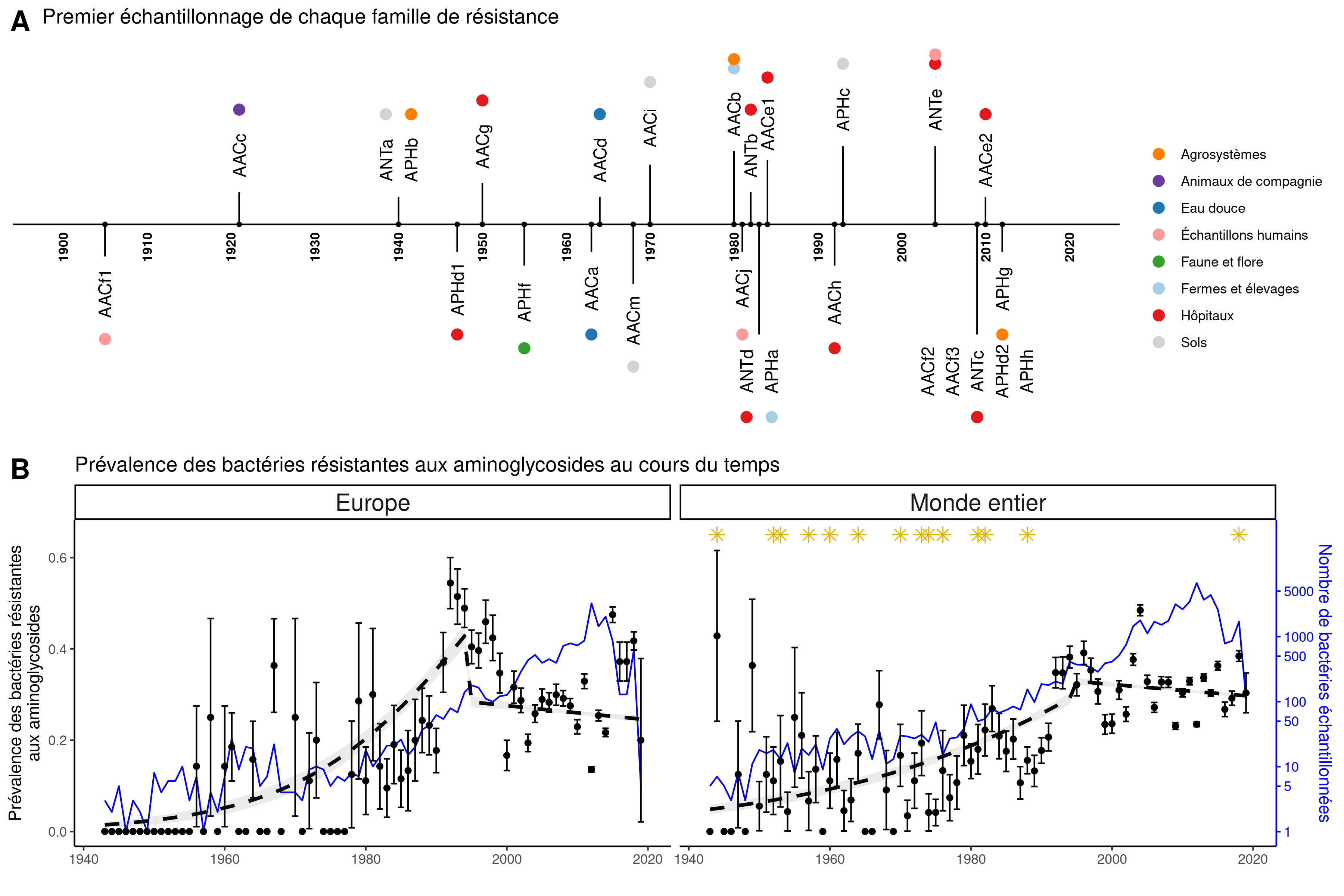
B. Evolution de la fréquence des génomes porteurs de résistances aux aminoglycosides depuis 1940 en Europe et dans le monde. En bleu (échelle de droite), nombre de génomes analysés pour chaque année. En noir (échelle de gauche), proportion de génomes porteurs d’un gène de résistance aux aminoglycosides pour chaque année. En pointillé, une tendance pour les périodes 1940-1995 et 1995-2019. Les étoiles jaunes représentent les dates d’introduction en clinique de nouveaux aminoglycosides.
Laboratoire CNRS impliqué
- Centre d’Ecologie Fonctionnelle et Evolutive (CEFE - CNRS / Université de Montpellier / EPHE / IRD)