Liens entre altération de la biodiversité et zoonoses : le cas des leishmanioses amazoniennes
Quels sont les effets de la crise de la biodiversité sur les maladies infectieuses ? Une étude parue dans la revue Molecular Ecology apporte de nouveaux éléments de réponse à cette interrogation. Les scientifiques ont utilisé des outils moléculaires innovants pour étudier un groupe de maladies zoonotiques transmises par des insectes vecteurs en Amazonie : les leishmanioses. Leurs résultats montrent qu'une altération locale de la diversité de mammifères sauvages a deux conséquences opposées sur la circulation de ces parasites : d'une part, les écosystèmes les plus appauvris sont dominés par des mammifères réservoirs de leishmaniose, ce qui contribue à accroître la transmission. Mais d’autre part, ces écosystèmes contiennent également des populations d'insectes vecteurs moins importantes. La cumulation de ces deux mécanismes induit donc un impact global relativement faible sur le risque d'infection.
L'impact potentiel des changements de biodiversité sur la transmission des maladies infectieuses zoonotiques (transmises à l'homme par d'autres animaux) est devenu un sujet de recherche important depuis deux décennies. Les avancées dans ce domaine ont mis en évidence différents processus pouvant mener à une augmentation ou à une diminution du risque selon le système et l'échelle considérés. De multiples études de terrain sont nécessaires afin de caractériser ces mécanismes pour différents agents infectieux et dans différents environnements. Cependant, l'obtention des données essentielles à l’étude de l'écologie de maladies infectieuses en milieu naturel est une tâche difficile. C'est à ces défis scientifiques et méthodologiques que cette étude tente de répondre.
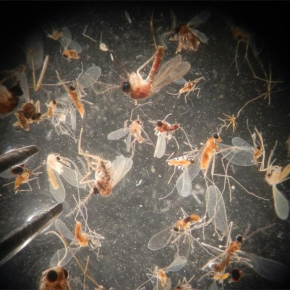
Les chercheurs ont étudié les leishmanioses amazoniennes, ensemble de maladies parasitaires zoonotiques circulant chez des mammifères sauvages en milieu forestier, et transmises par la piqûre de phlébotomes (petits diptères proches des moustiques). L'analyse moléculaire du contenu de centaines de pièges entomologiques, dans différents sites forestiers de Guyane, leur a permis d'estimer la prévalence des parasites ainsi que la diversité des espèces de phlébotomes et de mammifères (via l'ADN contenu dans les repas sanguins des diptères hématophages). Les résultats mettent en évidence une diminution de la diversité de mammifères dans les zones les plus impactées par l'homme, qui s'accompagne de deux conséquences contrastées sur la circulation des leishmanioses. D'une part, les espèces de mammifères connues pour transmettre ces maladies tendent à devenir prépondérantes dans les communautés de mammifères les plus appauvries, ce qui contribue à accroître le taux de prévalence des parasites dans les phlébotomes vecteurs (une observation cohérente avec l'hypothèse de "l'effet de dilution"1 ). Mais par ailleurs, les milieux où la diversité de mammifères est la plus pauvre contiennent des populations de phlébotomes moins denses. La cumulation de ces deux phénomènes opposés aboutit à un impact global relativement faible de la diversité de mammifères sur le risque de transmission.
Ces travaux démontrent une nouvelle fois que les changements de biodiversité influencent la transmission des maladies infectieuses au travers de différents mécanismes, et soulignent l'importance de prendre en compte l'écologie des insectes vecteurs. Par ailleurs, la méthodologie employée ouvre d'importantes perspectives pour l'étude écologique des maladies infectieuses. En effet, l'identification de plus de 50 espèces de vertébrés sauvages par l'analyse des repas sanguins de diptères est une illustration du potentiel de cette approche pour la réalisation d'inventaires de biodiversité.


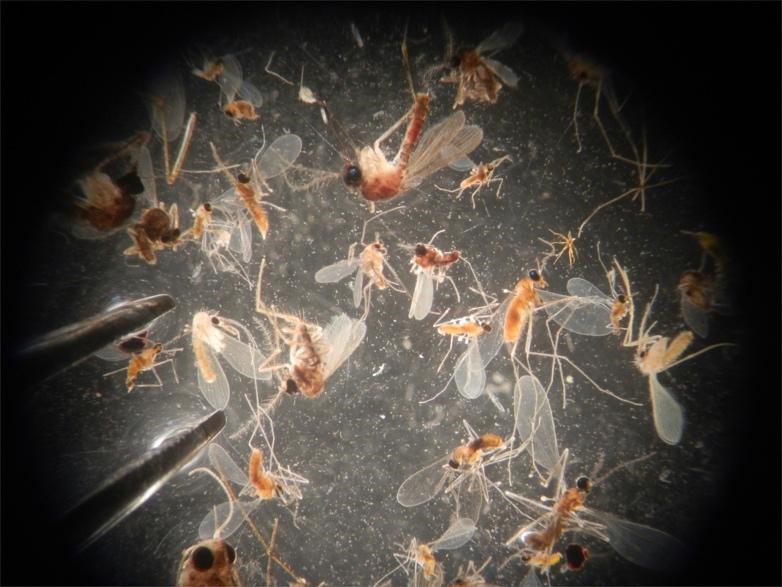
© Arthur Kocher
- 1Ensemble de mécanismes aboutissant à la réduction de la transmission de certains agents infectieux dans les écosystèmes les plus divers
Laboratoires CNRS impliqués
- Évolution et Diversité Biologique (EDB – CNRS / Univ. Toulouse III Paul Sabatier / IRD)
- Maladies Infectieuses et Vecteurs : Ecologie, Génétique, Evolution et Contrôle (MIVEGEC - Université de Montpellier / IRD / CNRS)
- Institut des Sciences de l’Évolution de Montpellier (ISEM - CNRS / Univ. Montpellier / IRD)
- Mécanismes Adaptatifs et Evolution (MECADEV - CNRS / MNHN)
- Centre d’Infection et d’Immunité de Lille (CIIL - CHU Lille / CNRS / Inserm / Institut Pasteur de Lille / Université de Lille)
Objectifs de développement durable

- Objectif 3 : Bonne santé et bien-être
- Objectif 15 : Vie terrestre
Ces travaux de recherche participent à la compréhension de l'impact des changements environnementaux sur la santé publique, et apporte des outils méthodologiques innovants pour l'étude des écosystèmes terrestres.
Référence
Biodiversity and vector-borne diseases: host dilution and vector amplification occur simultaneously for Amazonian leishmaniases. Kocher A, Cornuault J, Gantier JC, Manzi S, Chavy A, Girod R, Dusfour I, Forget PM, Ginouves M, Prévot G, Guégan JF, Bañuls AL, de Thoisy B, Murienne J. Molecular Ecology.